Atomet | Til kemisiden
Atomet
Atomet er den mindste enhed, som alle stoffer kan deles op i. Et atom kan godt deles i mindre partikler, men de er ens for alle atomer. Atomet er altså det mindste stykke, man kan have af et bestemt stof.
Man har i mange år spekuleret på, hvordan atomet er bygget op. Atomet er så småt, at det ikke giver mening at tale om, hvordan det ser ud, men man har fundet frem til en model, der på en nem måde viser, hvordan et atom er bygget op, og hvad det består af.
Niels Bohr viste i 1913, hvordan atomet måtte være bygget op - det fik han nobelprisen for!

Niels Bohr
Som sagt kan man ikke sige, at et atom ser ud på en bestemt måde. Man kan ikke se atomer i et mikroskop, og man kan ikke tage et billede af et atom og så bare forstørre det op. Derfor taler man altid om atom-modeller. En model beskriver, hvordan virkeligheden er uden selv at være en del af virkeligheden.
Man har lavet mange forskellige eksperimenter og beregninger, og ud fra de resulteter man fik, har man opbygget forskellige modeller. Jo mere man fandt ud af, jo rigtigere blev modellen. Niels Bohr fandt altså frem til den model, man bruger i dag.
Som et billede på, hvordan man har fundet ud af atomets opbygning, uden faktisk at kunne se atomer, kan man bruge et tankeeksperiment, med en mur.
Forestil dig en mur, man ikke kan se over eller gå rundt om. En forsker vil gerne finde ud af, hvad der er på den anden side.

Forskeren finder en metode til at finde ud af, hvad der er på den anden side af muren. Han kaster en sten over muren og registrerer, at der kommer en reaktion. Han bruger den viden, han allerede har til at finde ud af, at der med stor sansynlighed er tale om en hund på den anden side.
Alt efter hvilke metoder forskeren bruger, og hvilke resutetaer han får, må han drage en konklusion om, hvad der sikkert er på den anden side. Resultatet bruger han til evt. at lave yderligere undersøgelser.
Et eksempel på den måde at arbejde på, er da fysikeren Ernest Rutherford i 1907 fandt ud af, at atomet har en positiv kerne med negative partikler udenom. Før hans forsøg vidste man, at der fandtes positive og negative områder i et atom, men man mente, at de negative var jævnt fordelt i atomet som rosiner i en rosinbolle.
Rutherford beskød noget meget tyndt guldfolie med negative partikler og blev meget overrasket, da nogle af de negative partikler blev reflekteret tilbage igen. Den eneste forklaring på fænomenet var, at der var positive partikler klumpet sammen midt i atomet, så de i fællesskab ville kunne reflektere de negative partikler.
Til højre herfor ses en model af hydrogenatomet. Hydrogen er det simpleste atom, vi har.
Alle atomer har en positiv kerne i midten og negative elektroner i såkaldte skaller udenom. Hydrogenatomet har kun en enkelt positiv partikel i midten og en enkelt negativ partikel udenom. Den positive partikel kaldes en proton og den negative partikel kaldes en elektron.
Atomer består af næsten ingenting! Rutherford kunne beregne, at den positive kerne maksimalt havde en 1/10.000 af hele atomets udstrækning.
Tvis Skoles hovedbygning har en udstrækning på godt 100 meter diagonalt. Forestiller vi os, at vi har et atom af den diameter, ville kernen kun have en diameter på under en centimeter!
Alle andre atomer end hydrogenatomet har endnu en slags partikel ud over protonen og elektronen. Denne partikel findes også i atomets kerne, men har hverken positiv eller negativ ladning, men er neutral. Denne partikel kaldes for en neutron.
Et atom i sin grundtilstand har ca. lige mange protoner, neutroner og elektroner. Et eksempel er carbonatomet, der har seks af hver i sin mest almindelige form. Før i tiden kaldte man carbon for kulstof, og det er et af de stoffer, der oftest er med i forskellige, kemiske reaktioner.
Her er en model af et carbonatom:


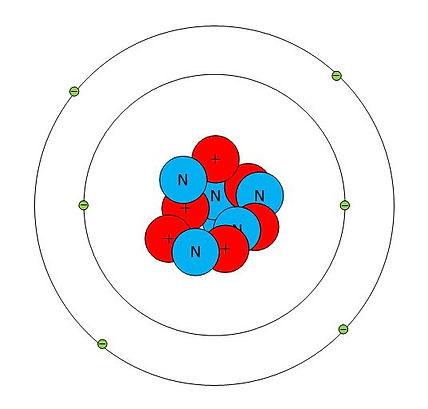
PROTONER findes i kernen og har en positiv elektrisk ladning, som man markerer med et plus.
ELEKTRONER findes i bestemte baner, kaldet skaller, rundt om kernen og har en negativ elektrisk ladning. En elektron vejer kun ca. 2000 gange så lidt som protonen.
NEUTRONER findes også i kernen, men er elektrisk neutrale, men vejer det samme som protonen.
På carbonatomet ser man, at elektronerne er fordelt på to skaller. Der kan være op til syv skaller, og antallet af elektroner i den yderste skal er meget vigtig for, hvordan stoffer reagerer kemisk med hinanden. Se evt. det faglige kursus "Kemiske reaktioner".
Et atom repræsenterer et såkaldt grundstof. Indtil videre har vi set på atomerne for grundstofferne hydrogen og for carbon.
Der findes 94 grundstoffer i naturen. Man kan godt i laboratorier frembringe flere, men de er helt ustabile og findes ikke naturligt.
Russeren Dmitrij Mendelejev opstillede i 1869 et skema, hvor alle grundstoffer kunne stilles i system efter hvor mange elektroner, de har i yderste skal, og hvor mange skaller, de har i alt. Grundsystemet er, at stofferne blev delt op i lodrette søjler, kaldet hovedgrupper, og vandrette rækker, kaldet perioder. Grundstoffet carbon findes i hovedgruppe fire, fordi carbonatomet har fire elektroner i yderste skal, og findes i anden periode, fordi det har to elektronskaller.
Dette skema kaldes det periodiske system.

Dmitrij Mendelejev
Hvis man klikker på det periodiske system her til venstre, kan man se, at carbon ligger i hovedgruppe 4 og i periode 2.
Vi kan også se, at hydrogen har nummer et og carbon har nummer seks. Det er antallet af protoner i atomet, der afgør, hvilket nummer, et grundstof har. Ingen grundstoffer har samme nummer og altså protontal!
Desuden har alle grundstofferne et kemisk symbol. Et grundstof kan kun have et stort bogstav og evt et eller to små bogstaver. Stoffet uran har fx symbolet "U". Stoffet jern har symbolet "Fe". Man skriver aldrig et symbol med flere store bogstaver, altså "FE" for jern er forkert!
Nu kender du atomets historie, hvordan det er bygget op, og hvordan det er organiseret i det periodeiske system. Dette faglige kursus er grundlæggende viden, der er meget vigtig for at forstå mange andre ting i fysik og kemi.
Grundstofferne er stoffer i deres rene form. Alle andre stoffer består af to eller flere grundstoffer, der sidder sammen. Læs videre om dette i det faglige kursus "Kemiske reaktioner". Nogle grundstofatomer afviger fra de "almindelige" atomer, idet de har flere eller færre neutroner i kernen end de typiske atomer har. Nogle atomer er også radioaktive. Disse "usædvanlige atomer" kan du læse mere om idet faglige kursus "Kernefysik". Der er også atomer, der kan finde nogle kemiske fordele ved at afgive eller modtage nogle negative elektroner. Dette kan du læse mere om i det faglige kursus "Ioner".

